La pratique de la pharmacie a considérablement évolué au cours des dernières décennies. Le pharmacien joue de plus en plus un rôle clinique et délègue les tâches techniques aux préparateurs en pharmacie. La littérature sur le rôle et l’impact du pharmacien et de ses collaborateurs est de plus en plus abondante; cette littérature peut être appréciée en consultant des plateformes (par exemple Impactpharmacie.org) ou en consultant les revues systématiques ou de littérature publiées. L’évolution de l’exercice de la pharmacie prend en compte le cadre légal en place; il peut être intéressant d’étudier les rôles et les impacts du pharmacien dans un pays donné.
Une étude exploratoire a été menée afin de recenser la littérature et mettre en évidence les différentes
caractéristiques du rôle des pharmaciens et l’impact de leurs activités en Belgique.
Pour cela une recherche a été effectuée dans les bases de données, PubMed, Embase et CINAHL entre 2006 et 2019. Deux membres de l’équipe ont sélectionné indépendamment les études sur la base du titre et du résumé. Celles qui ont été jugées potentiellement intéressantes ont été retenues pour une analyse complète. Toute divergence concernant l’inclusion de l’étude dans l’examen a été résolue par consensus.
Pour chaque étude incluse portant sur des questions liées à l’impact du pharmacien, les éléments suivants ont été extraits : type d’impact, mesure et effet de l’impact (positif, neutre ou négatif).
Au final, 65 articles ont été sélectionnés, dont 17 comportaient des mesures de l’impact de l’activité pharmaceutique. Sur les 35 mesures d’impact associées aux interventions pharmaceutiques, 23 incluaient des effets positifs, 12 des effets neutres et aucun des effets négatifs. Ces données font partie du plan d’action pour le développement de la pharmacie clinique dans les hôpitaux belges pour la période 2015-2020.
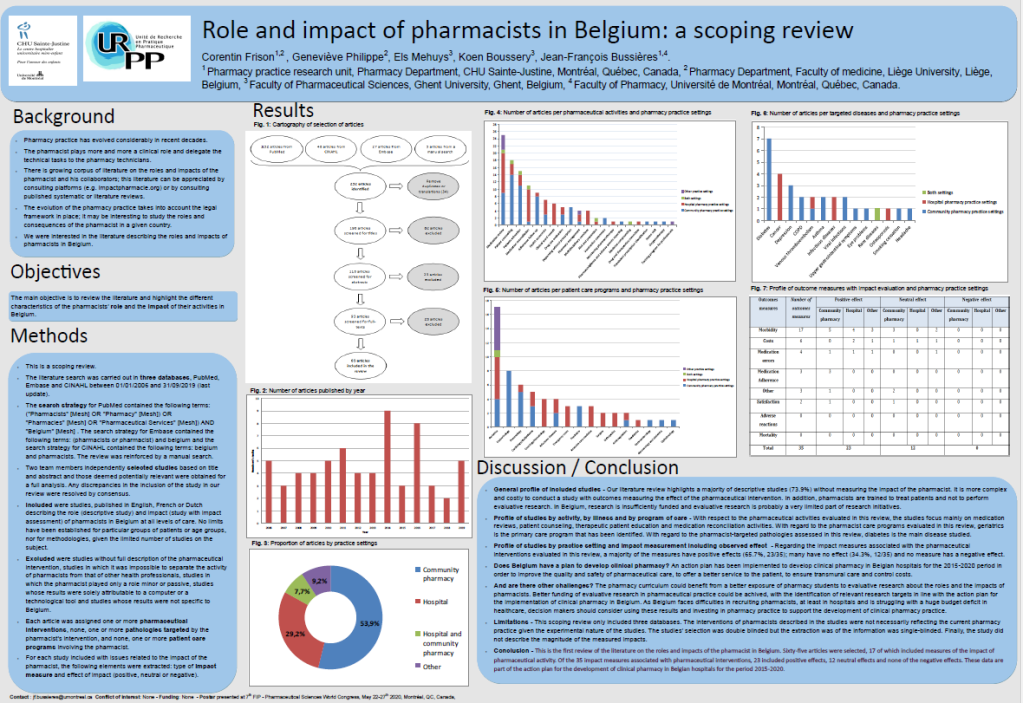
Vous pouvez consulter notre article publié dans la revue Le Pharmacien Hospitalier Clinicien et notre affiche présentée au 7ème FIP – Pharmaceutical Sciences World Congress, le 22 mai 2020, à Montréal, QC, Canada,










Vous devez être connecté pour poster un commentaire.